La quimioterapia es el principal medio de tratamiento de las infecciones por protozoos. El éxito de la quimioterapia depende en gran medida de la capacidad de aprovechar las diferencias metabólicas entre el patógeno y el huésped. Un problema al que se enfrenta la quimioterapia es la capacidad del patógeno para mutar y volverse resistente a los fármacos. A continuación se exponen ejemplos concretos de mecanismos de acción y resistencia a los fármacos.
Índice:
- Acción del fármaco
- La cloroquina y la vacuola alimentaria
- Antifolatos
- Fármacos que implican mecanismos redox
- Resistencia a los fármacos
- Cloroquina
- Otros enlaces
Acción de los fármacos
Los fármacos actúan interfiriendo específicamente en procesos celulares o bioquímicos, a menudo denominados "dianas". El ejemplo clásico de diana farmacológica es una enzima inhibida por el fármaco. Los fármacos eficaces mostrarán una toxicidad selectiva para el patógeno en comparación con el huésped. Muchos factores contribuyen a esta toxicidad selectiva (recuadro) y estos factores no se excluyen mutuamente. El diseño racional de fármacos trata de explotar estos diversos factores para desarrollar fármacos que sean altamente tóxicos para el patógeno y, al mismo tiempo, presenten una toxicidad mínima para el huésped.
La cloroquina y la vacuola alimentaria
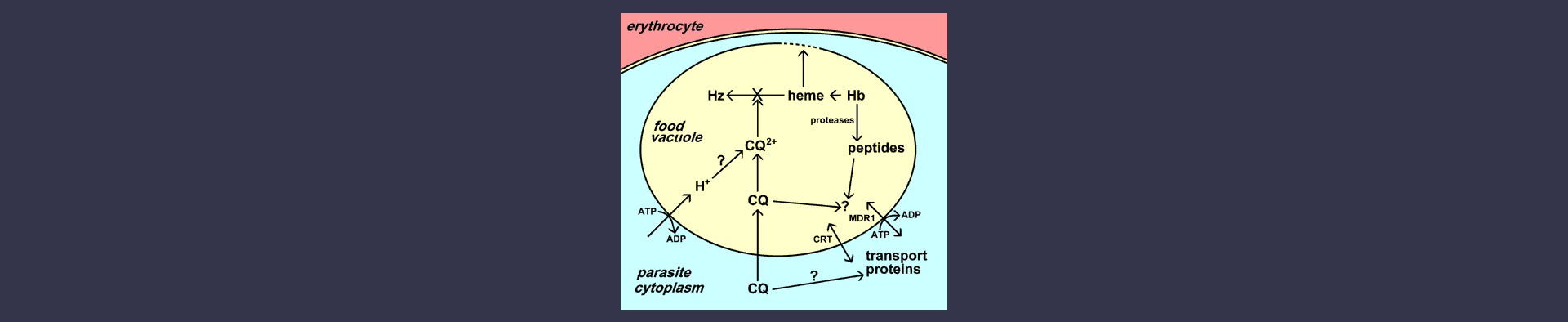
La vacuola alimentaria es un orgánulo similar al lisosoma en el que se produce la descomposición de la hemoglobina y la desintoxicación del hemo (véase un análisis más detallado de la vacuola alimentaria). La cloroquina se concentra hasta 1000 veces en la vacuola alimentaria del parásito. Los posibles mecanismos de esta acumulación selectiva de cloroquina en la vacuola alimentaria son: 1) protonación y atrapamiento iónico de la cloroquina debido al bajo pH de la vacuola alimentaria; 2) captación activa de la cloroquina por uno o varios transportadores del parásito; y/o 3) unión de la cloroquina a un receptor específico en la vacuola alimentaria.
La contribución exacta de estos tres mecanismos postulados no está clara, pero en general se acepta que la cloroquina ejerce su efecto tóxico interfiriendo en la conversión del hemo libre en hemozoína. Se liberan grandes cantidades de hemo como resultado de la digestión de la hemoglobina en la vacuola alimentaria. El hemo libre puede lisar las membranas, conducir a la generación de intermediarios reactivos del oxígeno e inhibir muchos otros procesos, por lo que es bastante tóxico. El hemo se desintoxica en la vacuola alimentaria mediante un proceso de biocristalización en el que el hemo se secuestra en grandes cristales insolubles llamados hemozoína o pigmento de la malaria. [Ver descripción más detallada de la formación de hemozoína]. Se desconoce el mecanismo exacto por el que la cloroquina inhibe la formación de hemozoína, pero la cloroquina puede unirse al hemo y esta unión puede impedir que el hemo se incorpore al cristal de hemozoína. Por lo tanto, la muerte del parásito es el resultado de la acumulación de desechos metabólicos (es decir, hemo) asociados a la digestión de la hemoglobina.
La cloroquina (CQ) se acumula en la vacuola alimentaria del parásito. Esta acumulación puede implicar el atrapamiento de iones tras la protonación, el transporte específico y/o la unión a un receptor (por ejemplo, el hemo). La principal acción de la cloroquina es inhibir la formación de hemozoína (Hz) a partir del hemo liberado por la digestión de la hemoglobina (Hb). El hemo libre lisaría entonces las membranas y provocaría la muerte del parásito. La resistencia a la cloroquina se debe a una menor acumulación de cloroquina en la vacuola alimentaria. Dos transportadores diferentes (CRT y MDR1) han sido implicados en la resistencia. Se desconocen las funciones de estos transportadores y su papel exacto en la resistencia a la cloroquina.
Otros antipalúdicos que contienen quinolina, como la mefloquina y la quinina, también parecen afectar a la vacuola alimentaria. Sin embargo, no está claro si estos fármacos se unen al hemo o afectan a la formación de hemozoína. Además, estos fármacos son bases más débiles que la coroquina y es posible que no presenten el mismo grado de captura de iones dentro de la vacuola alimentaria.
La vacuola alimentaria ofrece muchas dianas farmacológicas potenciales. Además de la inhibición de la formación de hemozoína comentada anteriormente, también se están investigando inhibidores específicos de las proteasas implicadas en la digestión de la hemoglobina como posibles antimaláricos.[Ver discusión más detallada sobre las proteasas de la vacuola alimentaria]. Las funciones especializadas de digestión de la hemoglobina y formación de hemozoína son exclusivas del parásito y no se encuentran en el hospedador. Además, ambas funciones (generación de aminoácidos a partir de la hemoglobina y desintoxicación del hemo) son muy importantes para el parásito.
Antifolatos
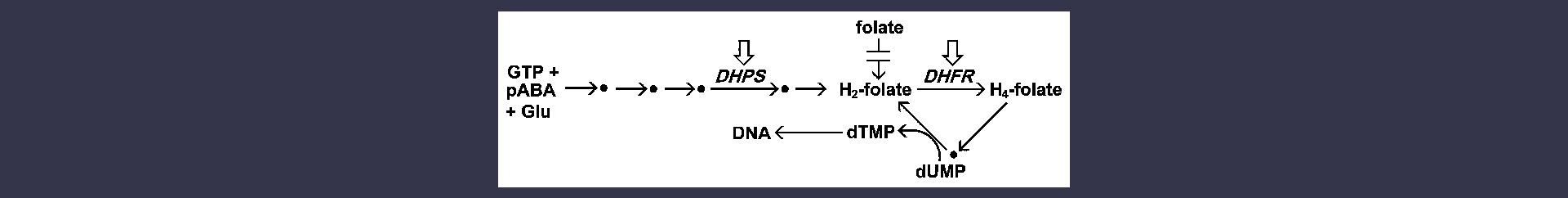
El metabolismo del folato es el objetivo de varios antipalúdicos, así como de fármacos utilizados contra otros patógenos. Los folatos reducidos sirven como cofactores en muchas reacciones de transferencia de un carbono implicadas en la biosíntesis de aminoácidos y nucleótidos (véase más sobre vitaminas y cofactores). Debido a su elevada tasa de replicación, el parásito de la malaria tiene una gran demanda de nucleótidos como precursores para la síntesis de ADN (véase más sobre nucleótidos y ácidos nucleicos), por lo que es especialmente sensible a los antifolatos. Las dos dianas principales del metabolismo antifolato son la biosíntesis de novo de folatos y la dihidrofolato reductasa (DHFR).
El parásito de la malaria sintetiza folatos de novo, mientras que el huésped humano debe obtener folatos preformados y no puede sintetizarlos. La incapacidad del parásito para utilizar folatos exógenos convierte la biosíntesis del folato en una buena diana farmacológica. El folato se sintetiza a partir de 3 componentes básicos, GTP, ácido p-aminobenzoico (pABA) y glutamato, en una vía en la que intervienen 5 enzimas. Una de estas enzimas, la dihidropteroato sintasa (DHPS), es inhibida por los medicamentos a base de sulfamidas. La sulfadoxina y la dapsona son dos antipalúdicos comunes que actúan sobre la DHPS. Las sulfamidas son análogos estructurales del pABA y la DHPS los convierte en aductos no metabolizables. Esto conduce a un agotamiento de la reserva de folato y por lo tanto reduce la cantidad de timidilato disponible para la síntesis de ADN.
Esquema simplificado del metabolismo del folato. El parásito de la malaria sintetiza folatos de novo, pero no puede utilizar folatos preformados. Los folatos participan como cofactores en muchos procesos biosintéticos. Cabe destacar la síntesis de timidilato (dTMP), necesario para la síntesis del ADN. Las dos dianas principales de los fármacos antipalúdicos que actúan sobre el metabolismo de los folatos se indican con flechas en recuadro.
La DHFR es una enzima ubicua que participa en el reciclaje de los folatos reduciendo el dihidrofolato a tetrahidrofolato. A continuación, el tetrahidrofolato se oxida de nuevo a dihidrofolato al participar en reacciones biosintéticas (por ejemplo, timidilato sintasa). La inhibición de la DHFR impedirá la formación de timidilato y provocará la detención de la síntesis de ADN y la posterior muerte del parásito. La pirimetamina y el proguanil son los dos inhibidores de la DHFR más utilizados como antipalúdicos. Estos fármacos inhiben la DHFR del parásito en mayor medida que la enzima del huésped, por lo que muestran una toxicidad selectiva hacia el parásito.
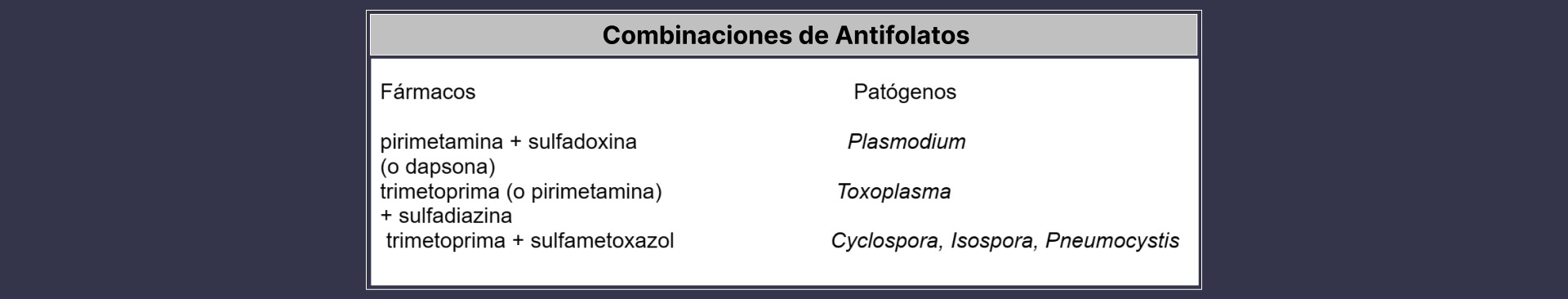
En la mayoría de los casos, los inhibidores de la DHPS y la DHFR se utilizan en combinación (Tabla) para obtener un efecto sinérgico y frenar el desarrollo de farmacorresistencia. Las mutaciones puntuales específicas de estas enzimas provocan una menor afinidad por los fármacos. La resistencia tiende a desarrollarse rápidamente en presencia de presión farmacológica en situaciones en las que una sola mutación puede provocar resistencia a los fármacos. El uso de combinaciones de fármacos ralentizará el desarrollo de resistencia, ya que deben producirse dos mutaciones independientes para que se desarrolle resistencia contra ambos fármacos. Fansidar, una combinación de sulfadoxina y pirimetamina, se utiliza ampliamente para el tratamiento de la malaria falciparum no complicada. La trimetoprima, similar a la pirimetamina, suele utilizarse en combinación con otras sulfamidas para el tratamiento de coccidios (Toxoplasma, Cyclospora e Isospora) y Pneumocystis.
Se cree que varios fármacos antiprotozoarios actúan a través del estrés oxidativo (Tabla). Los procesos metabólicos producen intermediarios reactivos del oxígeno (ROI) que pueden dañar componentes celulares como lípidos, proteínas y ácidos nucleicos (véase la revisión sobre estrés oxidativo). La alta actividad metabólica de la mayoría de los patógenos protozoarios dará lugar a la producción de niveles aún más altos de ROI. Este es el caso del parásito de la malaria, que produce ROI como consecuencia de la digestión de la hemoglobina y la liberación de hemo libre. [Véase una descripción más detallada del hemo y la ROI].
Todas las células tienen mecanismos mediante los cuales se puede desintoxicar la ROI (p. ej., metabolismo redox). Los fármacos que aumentan específicamente los niveles de estrés oxidativo en el parásito pueden sobrecargar estos mecanismos de defensa de la ROI y provocar la muerte del parásito. Los niveles de estrés oxidativo pueden ser aumentados por fármacos que son oxidantes directos, así como por fármacos que participaron en el ciclo de oxidación-reducción, a veces llamado ciclo redox fútil.
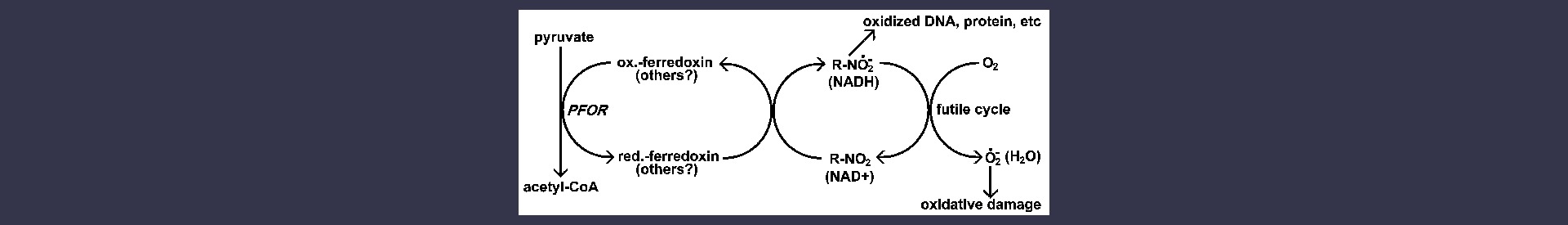
Muchos de los fármacos que participan en las reacciones redox necesitan ser activados antes de ser eficaces contra su(s) diana(s). Por ejemplo, el metronidazol y otros nitroimidazoles son fármacos de amplio espectro que afectan a una gran variedad de bacterias anerobias y protozoos. Estos fármacos se activan mediante la reducción del grupo nitro a un radical aniónico. El radical aniónico es muy reactivo y forma adyuvantes con las proteínas y el ADN, lo que provoca una pérdida de función. En particular, las reacciones con el ADN provocan la rotura de la cadena y la inhibición de la replicación, lo que conduce a la muerte celular. La reducción de los nitroimidazoles requiere fuertes condiciones reductoras y los organismos anaerobios tienen más potencial reductor que los aerobios. Esto explica la selectividad de estos compuestos para los organismos anaerobios. En otras palabras, los fármacos son activados preferentemente por los patógenos.
En el caso del metronidazol, la ferredoxina reducida parece ser el principal donante de electrones responsable de su reducción (Figura). Existe una buena correlación entre la presencia de la piruvato-ferredoxina oxidorreductasa (PFOR) y la sensibilidad al metronidazol. Los tres protozoos afectados por el metronidazol (Tabla) carecen de mitocondrias y tienen una PFOR similar a la que se encuentra en muchas bacterias anaerobias. Los organismos aerobios con mitocondrias utilizan la piruvato deshidrogenasa en lugar del PFOR para la producción de acetil-coenzima A.
Acciones de los nitroimidazoles. Los nitroimidazoles (R-NO2) son activados por el parásito mediante una reducción a un radical aniónico. Este radical aniónico altamente reactivo daña el ADN y las proteínas, provocando la muerte del parásito. El metronidazol parece ser reducido específicamente por la ferredoxina en Giaridia, Entamoeba y Trichomonas. Los organismos aerobios utilizarían otros donantes de electrones para la reducción de los nitroimidazoles y también existiría la posibilidad de establecer ciclos fútiles que llevarían a la generación de ROI en los que el oxígeno es el aceptor final de electrones. Normalmente las NAD oxidorreductasas llevan a cabo ciclos redox siendo el agua el producto final.
Los nitroimidazoles (p. ej., benznidizol) y los compuestos nitrofuránicos relacionados (p. ej., nifurtimox) también son eficaces contra Trypanosoma cruzi. Se desconocen los donantes de electrones responsables de la reducción inicial de estos fármacos y no está clara la base de la especificidad para el parásito. Ambos fármacos son algo tóxicos y no presentan buenos índices terapéuticos. Se cree que el mecanismo de acción del nifurtimox implica ciclos redox inútiles tras su reducción, mientras que se especula que el benznidizol inhibe reductasas específicas y, por tanto, disminuye la capacidad del parásito para eliminar ROI.
La aparición de farmacorresistencia limita gravemente el arsenal de fármacos disponibles contra los patógenos protozoarios. Los parásitos han desarrollado numerosas formas de superar la toxicidad de los fármacos (recuadro). Muy a menudo, la farmacorresistencia implica mutaciones en la diana del fármaco, de modo que éste no se une o inhibe tan bien la diana. La farmacorresistencia puede desarrollarse rápidamente en situaciones en las que una única mutación puntual puede conferir resistencia. Otro mecanismo de resistencia implica la expresión de niveles más altos de la diana. Esto puede lograrse mediante un aumento de la transcripción y la traducción o la amplificación del gen. El resultado es la necesidad de niveles más altos de fármacos para lograr el mismo nivel de inhibición. La disminución de la acumulación del fármaco o su metabolización en productos no tóxicos hará que llegue menos fármaco a la diana y también puede contribuir a la farmacorresistencia. La farmacorresistencia también puede implicar la acumulación de mutaciones en la misma diana o en dianas diferentes que tendrán efectos aditivos o sinérgicos. Los parásitos con mutaciones o polimorfismos genéticos que confieren una disminución de la sensibilidad a los fármacos serán seleccionados bajo presión farmacológica.

Cloroquina
La resistencia a la cloroquina se asocia a una disminución de la cantidad de cloroquina que se acumula en la vacuola alimentaria, el lugar de acción de la cloroquina (véase más arriba). El mecanismo de esta menor acumulación es controvertido. Algunos estudios han demostrado que la disminución de la acumulación del fármaco se debe a un aumento de su eflujo. Mientras que otros estudios sugieren que la disminución de los niveles de acumulación de cloroquina es más importante. La observación de que el verapamilo y otros fármacos relacionados pueden revertir el fenotipo resistente a la cloroquina ha llevado a especular que un transportador dependiente de ATP desempeña un papel en el eflujo del fármaco y la resistencia a la cloroquina, similar a la resistencia a múltiples fármacos (MDR) en el cáncer. Se ha identificado un transportador similar a la MDR, designado PfMDR1, en la membrana de la vacuola alimentaria. Sin embargo, no se ha podido demostrar ninguna correlación definitiva entre PfMDR1 y la resistencia a la cloroquina. No obstante, no puede descartarse un papel auxiliar de PfMDR1 en la resistencia a la cloroquina.
Un cruce genético y estudios cartográficos entre un clon resistente a la cloroquina y un clon sensible a la cloroquina dieron como resultado la identificación de una región de 36 kb en el cromosoma 7 asociada a la resistencia a la cloroquina. Uno de los 10 genes de esta región de 36 kb codifica una proteína con 10 dominios transmembrana y se asemeja a una proteína transportadora similar a los canales de cloruro. El gen se ha designado como pfcrt y la proteína se localiza en la membrana de la vacuola alimentaria. Varias mutaciones en el gen pfcrt muestran correlaciones con el fenotipo de resistencia a la cloroquina y una mutación, una sustitución de una treonina (T) por una lisina (K) en el residuo 76 (K76T) muestra una correlación perfecta con la resistencia a la cloroquina. Presumiblemente, estas mutaciones afectan a la acumulación de cloroquina en la vacuola alimentaria, pero se desconoce el mecanismo exacto de la resistencia a la cloroquina. Además, la observación de que la resistencia a la cloroquina ha surgido relativamente pocas veces y se ha extendido posteriormente ha llevado a especular sobre la participación de múltiples genes en el desarrollo de la resistencia (véase más discusión).
Lecturas adicionales
Foley M y Tilley L (1998) Quinoline antimalarials. Mecanismos de acción y resistencia y perspectivas de nuevos agentes. Pharmacology & Therapeutics 79:55
Hyde JE (2007) Drug-resistant malaria -- an insight. FEBS Journal 274, 4688-4698.
Ouellette M (2001) Biochemical and molecular mechanisms of drug resistance in parasites. Trop Med Int Health 6:874.
Rosenthal PJ y Goldsmith RS (2001) Antiprotozoal drugs. En Basic and Clinical Pharmacology, 8ª edición. McGraw-Hill Companies Inc. (Edición en línea disponible a través de Stat!Ref Books en Tulane Medical Library)
Samuelson J (1999) Why metronidazole is active against both bacteria and parasites. Antimicrob Agents Chemother. 43:1533.
Wellems TE y Plowe CV (2001) Paludismo resistente a la cloroquina. J Inf Dis 184:770.
Original Article: http://www2.tulane.edu/~wiser/protozoology/notes/drugs.html